强酸总是以一种让人望而生畏的面目出现,好像它能够腐蚀一切物质。当然,强酸的能力并没有那么强,也没有那么恐怖,实际上,强酸是我们生活中必不可少的一部分,比如在我们胃里胃酸就是属于盐酸,也是一种强酸,没有它我们将无法很好的消化食物。此外醋酸也是一种很重要的调味品。
什么是强酸?
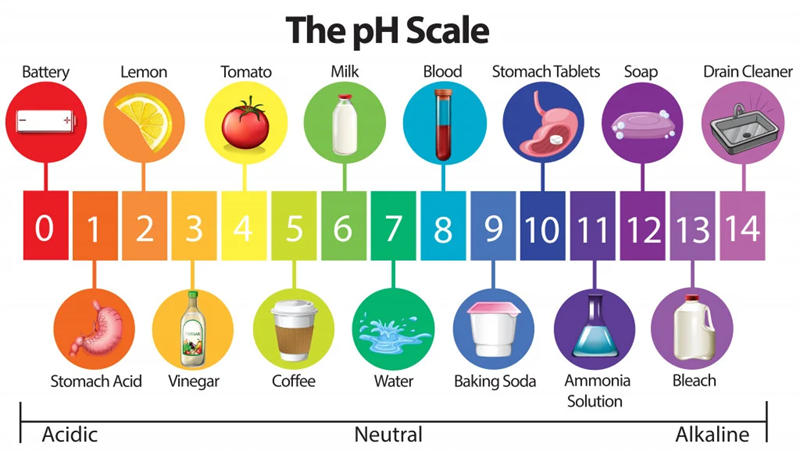
酸的强度通常取决于它溶解在水(布朗斯台德酸)中时提供质子(H+)的能力。通常我们使用PH值来表示酸或碱的强度。
它的范围从0(最酸性)到14(最碱性)。
我们使用一个简单的公式pH=-log10[H+]来确定pH值,其中 [H+]是以mol/L表示的质子浓度。
所以,当我们谈论强酸时,我们指的是pH值0到2的范围。强酸是根据其快速提供质子来识别的,其中一些强酸具有很强的腐蚀性,例如HCl,H 2SO4,HNO3,苦味酸等。弱酸包括乙酸(醋),柠檬酸(柠檬),苯甲酸等。
酸的相对介电常数(ε)
相对介电常数也称为液体的“介电常数”。它是保持两个带电粒子分离所需的力的量度。介电常数值越高,保持带电粒子分离所需的力就越小。介电常数的计算公式为:
ε r = ε / ε 0
ε=介电常数–取决于两个电荷之间介质的性质
ε 0=真空的介电常数–常数– 8.854 × 10 −12 J −1 C 2 m −1。
介电常数是无量纲的量。例如,我们总是取真空的介电常数为1,水在250C时的介电常数为78,即几乎是真空的两倍。这仅仅意味着在真空中,两个带电粒子无法分离,因为真空对离子间力的阻力较小,而在水中,两个带电粒子可以保持原样并保持稳定。
如果一种物质的组成分子很容易被极化,那么它的介电常数就很大。在水中,由于高负电性氧原子与正电性氢原子结合,因此具有高极性。这使水成为一种很好的极性溶剂,这就是为什么它通常被称为“万能溶剂”的原因。
在谈论强酸时,我们假设它们是高度可电离的,因为只有这样它们才能提供质子。事实上,大多数强酸的介电常数都大于水。
这意味着物质比水更容易溶于酸。因此,强酸在自然界中具有很强的腐蚀性,因为它们溶解物质的速度非常快。该反应是高度放热的,这会增加物质的温度。

温度对溶解度的影响
水作为一种通用溶剂,在反应和过程中有许多应用。许多物质很容易溶于水,而有些物质需要加热才能溶解。当我们提供额外热量的时候,我们基本上是在增加溶质的动能。当它们获得能量时,它们的运动会加速并分解,然后被挤压在溶剂分子之间。
当我们加热溶质时,分子从有序的排列散落成混乱的排列。因此,一般趋势是,当我们将固体溶解在水中时,随着温度升高,溶解度会增加(气体则相反)。
强酸也是如此。当我们放入热物质时,我们会为酸提供更多能量,从而增加电离能力,从而略微增加其介电常数。因此,与冷物质相比,强酸能够更快地溶解物质。
在应用这个概念时,我们应该问自己:我们应该吃热的食物还是冷的食物,因为我们的胃里有一种很强的酸——HCl?与吃冷食相比,吃热食更容易消化。
当食物很热时,它会分解一些营养物质或使它们更容易被酸迅速分解。另一方面,冷食需要更多的时间和能量来分解。
因此,消化热食和冷食所需的时间是不同的。

结论
由于高介电常数,强酸很容易溶解物质,无论其性质如何。热物质比冷物质溶解得更快,因为它们具有高热能,这有助于酸快速溶解,而冷物质会从酸本身吸收一些热量使其达到室温,从而减慢溶解过程。


如果您觉得我们的文章对您有用,您可以关注微信公众号或者给作者打赏。您的关注和赞赏是我们继续创作的动力!!
原创文章,配图来自AI创作,作者:浩瀚科普网,如若转载,请联系我们:thinkou@126.com